
近日,由广东先康达生物科技有限公司(隶属于先康达集团,以下简称“广东先康达”)自主研发的免疫细胞无血清培养基成功通过了美国食品药品监督管理局(FDA)DMF备案。
免疫细胞无血清细胞培养基通过DMF备案是先康达集团在细胞培养领域深耕多年的重要成果,这意味着先康达集团的生产工艺和品质控制体系已经达到了国际标准和监管要求,其产品质量可靠、安全性高。

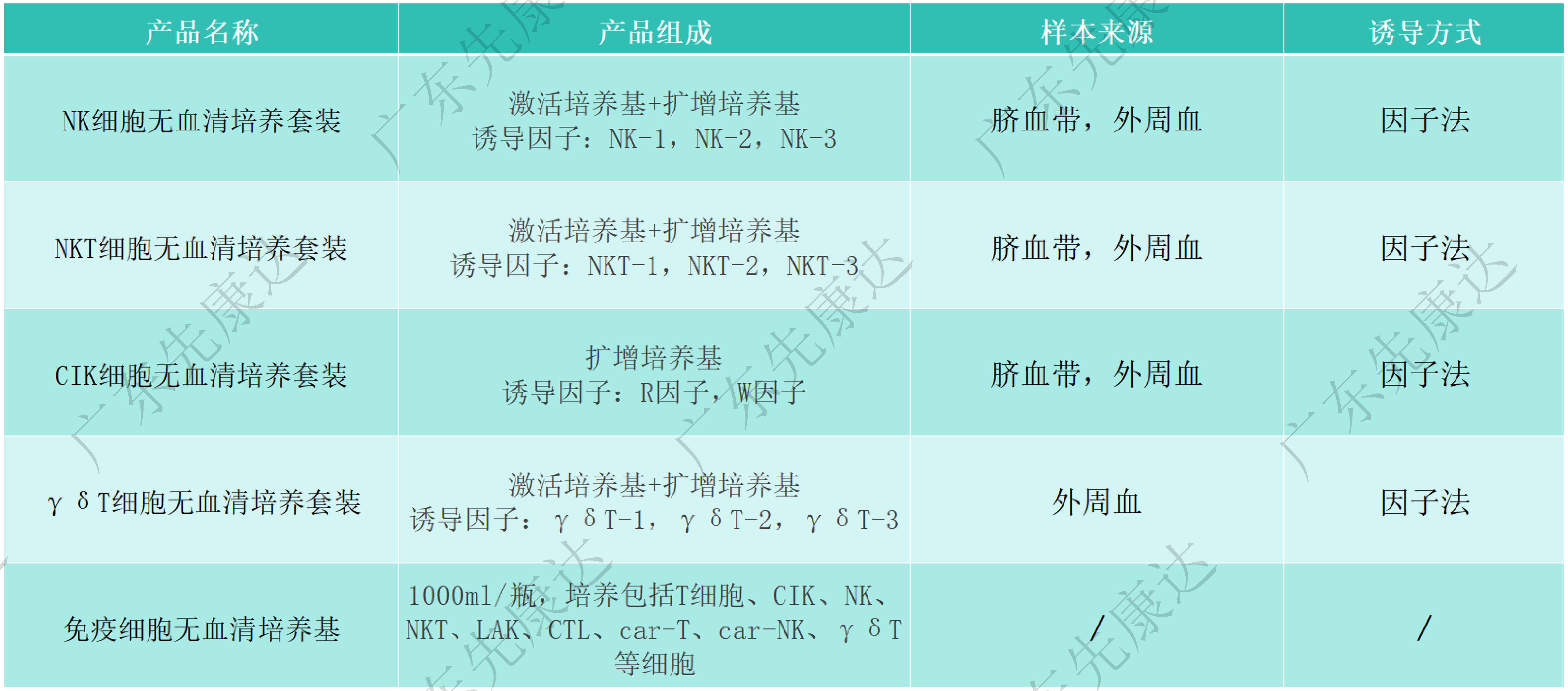
此免疫细胞无血清培养基化学成分明确,专为NK、NKT等特定类型细胞的增殖培养设计,可明显提升免疫细胞的增殖和激活效率,有效推动免疫细胞的工艺体系和质量体系构建以及临床研究进展。相比传统含血清培养基,无血清培养基避免了血清带来的免疫排斥反应和病原微生物污染风险,为细胞培养提供了更加纯净、稳定的环境。同时,通过添加特定的生长因子和细胞因子,该产品能显著促进细胞增殖与分化,满足科研和临床应用的多种需求。
基于免疫细胞无血清培养基,研发团队通过不断探索和优化配方,成功开发出了一系列性能优异、适用性广的无血清培养基产品,为相关免疫细胞的临床研究和应用提供了更多的保障和便利。
此次DMF备案成功,是对先康达集团研发实力、技术创新、质量控制和生产能力的认可,也提升了其产品在国际市场上的竞争力与认可度。未来,先康达集团将继续秉承“创新、质量、服务”的核心理念,不断探索与突破,为全球生物医药领域带来更多高品质产品与解决方案。同时,也将继续加强与国内外科研机构和企业的深度合作与交流,共同推动生物医药技术的革新与发展。
关于DMF
DMF,全称Drug Master Files,是呈交FDA的存档待审资料,内容包含用于人体的药物产品在生产、加工、包装和储存过程中用到的生产设施、工艺流程、质量控制及其所用原料、包装材料等详细信息。FDA会对这些资料进行审核,以确保产品的安全性、质量和生产流程的合规性。