
复旦大学附属肿瘤医院邵志敏教授、江一舟教授团队在国际医学旗舰期刊Med发表封面论文,揭示了一种名为“CCL19+树突状细胞”的细胞亚群,在三阴性乳腺癌免疫治疗过程中发挥影响疗效的关键作用。这为破解三阴性乳腺癌精准免疫治疗难题提供了新的方向。
据悉,乳腺癌是目前全球女性发病率最高的恶性肿瘤。其中,三阴性乳腺癌约占乳腺癌总体人群的15%,因其恶性程度最高、患者生存时间较短、缺乏有效治疗靶点,素有“最毒乳腺癌”之称。近年来,多项临床试验证实,以PD-1/PD-L1抑制剂为代表的免疫疗法成为三阴性乳腺癌颇具前景的治疗手段,但仍有部分患者难以获益。
邵志敏、江一舟团队深耕乳腺癌精准治疗,首创三阴性乳腺癌“复旦分型”,并据此开展一系列临床试验,将“无药可治”的三阴性乳腺癌的治疗有效率提高了3倍。近年来,研究团队从蛋白、代谢、免疫、微生物等多个角度不断深化“复旦分型”,探寻新的治疗靶点,以突破部分三阴性乳腺癌亚型的治疗瓶颈。
肿瘤微环境是肿瘤赖以生存的“土壤”,寻找其中的关键细胞亚群从而提高精准治疗疗效是乳腺癌治疗研究的重要方向。树突状细胞作为最重要的先天免疫细胞之一,在肿瘤微环境中发挥“侦察兵”的关键作用。但目前对于哪一类树突状细胞亚群最重要,可以精准定向免疫治疗,仍缺乏系统研究。
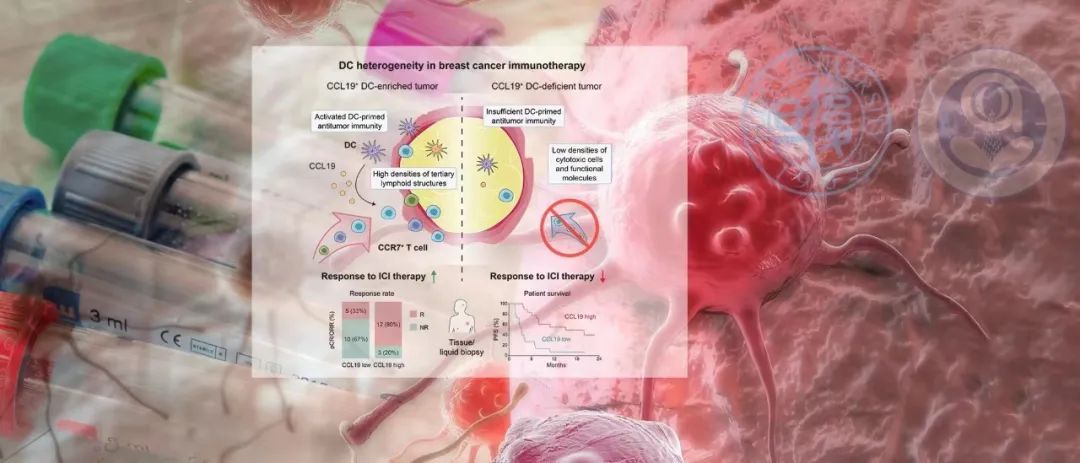
为此,邵志敏、江一舟团队开展了系列研究。通过解析来源于临床试验的“一手”单细胞测序数据,研究团队揭示了一种名为“CCL19+树突状细胞”的细胞亚群,在三阴性乳腺癌治疗中发挥影响免疫治疗疗效的关键作用。多项独立临床试验证实,肿瘤微环境中这种细胞浸润可以提示三阴性乳腺癌患者的免疫治疗有效。后续研究发现,向体内输注这群细胞后,PD-1单抗疗效即可成倍增加,显著抑制肿瘤生长。
CCL19+树突状细胞为何如此高效?基于大规模患者队列、新鲜患者肿瘤组织分析、石蜡切片多重染色等多种方法,研究者发现CCL19+树突状细胞是一群功能成熟的细胞亚群,具有高效的免疫调节能力,在具有该种细胞的肿瘤中,免疫杀伤能力处于高度激活状态。
机制探索发现,该类树突状细胞通过关键功能分子CCL19影响CCR7+记忆性T细胞,进而与免疫治疗发挥协同作用,而联合使用CCL19与PD-1单抗可以进一步促进T细胞的肿瘤杀伤作用,激活三阴性乳腺癌抗肿瘤免疫。因此,基于CCL19的治疗方式可以作为提高三阴性乳腺癌免疫治疗疗效的潜在治疗策略。
如何能让这一发现令更多三阴性乳腺癌患者获益?研究者使用大规模配对的三阴性乳腺癌配对肿瘤、外周血样本开展研究,发现肿瘤内CCL19水平与外周血循环CCL19水平明显正相关。通过国内外多项临床试验验证,研究者发现不仅肿瘤内的CCL19水平与免疫治疗疗效相关,血浆CCL19水平同样可以预测免疫治疗疗效。
对于晚期三阴性乳腺癌,外周血CCL19高的患者有80%能获得超过30%肿瘤退缩,而CCL19低的患者中获得明显肿瘤退缩的比例不足35%。通过酶联免疫吸附检测技术检测外周血CCL19,有望实现免疫治疗患者的无创监测,做到疗效动态预测,及时调整治疗方案,提高患者预后。目前,相关研究已经申请发明专利。
江一舟表示,当前肿瘤诊断及疗效检测主要依赖侵入性组织活检,不仅对患者创伤大,而且耗时长、价格高昂。通过外周血等采集相关信息的无创液体活检,可以实现简便、无创、快速、低成本,克服了既往标志物预测效能不够高、需要有创组织活检两大痛点,有望在有效提升三阴性乳腺癌治疗效果的同时,减轻患者的医疗经济负担。