
有研究发现,年轻人的皮肤受伤后,会迅速修复自愈,而老年人的伤口愈合却较为缓慢;同样,相较年轻人,老年人其他组织在受到损伤后,所需要的修复时间也更长,且恢复效果往往更差。这些现象说明衰老可引起组织再生功能降低,阻碍组织有效的损伤修复。
“什么控制着器官再生?”“我们可以阻止自己衰老吗?”是《科学》杂志公布的全球颇具挑战性的科学问题。“再生”是机体组织应对损伤进行修复及重塑的生物学过程,对维持器官功能稳态具有重要作用,体现了生命自我修复与组织重建的能力。而衰老是随时间的推移,生物体功能逐渐下降、身体结构逐渐受损的生物学过程,表明生命的有限性与定向性。“再生”和“衰老”均是高度复杂的系统生物学过程。二者既相互对立,又紧密联系。然而,目前仍然缺少从系统水平解码衰老伴随的组织再生障碍和衰老过程中再生能力变化规律的研究。同时,由于组织的异质性,不同组织器官再生是否遵循共同的调控规律?能否通过挖掘再生障碍相关的生物标志物及关键调控基因,发展调控再生、干预衰老及其相关疾病的新策略?这些关键科学问题亟待探明。
10月27日,中国科学院动物研究所刘光慧研究组、曲静研究组,联合北京基因组研究所张维绮研究组,在《细胞•干细胞》(Cell Stem Cell)上,在线发表题为Decoding aging-dependent regenerative decline across tissues at single-cell resolution的研究论文。该研究通过在年轻和年老小鼠中构建八种组织器官损伤后再生修复模型,首次在单细胞分辨率系统比较了不同组织中参与再生修复过程的分子动态变化规律,揭示了干细胞响应和血管生成能力降低是年老组织再生功能障碍的关键因素,并鉴定出年轻器官强再生能力相关的巨噬细胞新亚群。该成果有助于增加科学家对增龄伴随的再生异常及器官退行规律的认知,为发展促进组织再生、延缓衰老的干预策略提供了新的线索和思路。
该研究利用小鼠作为模式动物构建了八种组织损伤后再生修复模型,包括肝脏部分切除损伤、骨骼肌冷冻损伤、皮肤缺损损伤、后肢缺血损伤、小肠辐照损伤、肺脏化学损伤、骨髓辐照损伤及心肌缺血损伤。研究通过一系列生理功能检测和组织学分析发现,在年轻的小鼠个体中,除了心肌再生能力极低外,其他的组织均具备一定的损伤后修复能力,且这些组织的再生修复能力均随机体衰老发生显著下调。
为了解析衰老导致再生功能障碍的分子机制,科研人员绘制了跨年龄、跨组织的损伤修复动态时序单细胞转录谱,并建立了三套分析模式来比较年轻和年老组织对于损伤的响应机制,即损伤后的急性响应期的异同,损伤后不同阶段的转录组差异以及再生全过程的基因表达动态变化。研究发现,组织炎症异常、细胞死亡增加和血管新生能力降低是导致衰老组织再生功能障碍的重要因素。
进一步,该研究对跨越不同器官普遍存在的细胞类型(如免疫细胞,内皮细胞及成体组织干细胞)进行比较分析。结果发现,再生过程中年轻的免疫细胞和内皮细胞会高水平表达促进损伤修复和血管生成相关基因,这提示了它们可能是赋能年轻机体更强损伤修复活性的关键细胞类型。此外,年轻和年老的组织损伤后激活的干细胞亚群不同,年老特异的干细胞亚群低表达分化相关的基因,同时高表达细胞衰老基因,说明衰老组织中的干细胞处于低活性状态。
进而,该工作鉴定出一群高表达Arg1的巨噬细胞(Arg1+巨噬细胞)。这群细胞表现出组织修复相关的分子特征,并高表达与内皮细胞增殖、生长因子产生、伤口愈合和血管生成调节相关的基因。结合进一步的实验验证,研究发现,这群细胞可能通过与内皮细胞相互作用,促进血管新生。Arg1+巨噬细胞的数量在年轻组织的再生修复过程中受到精密调控,在再生修复早期显著增加,并很快恢复至损伤前水平。而在年老组织中,这群细胞的数量在稳态阶段高于年轻组织,但损伤修复过程中并未出现剧烈变化(图1)。这提示衰老组织中的再生相关免疫细胞处于一种“脱敏”的“低弹性”状态,可能阻碍了器官损伤后的及时组织重塑和修复。
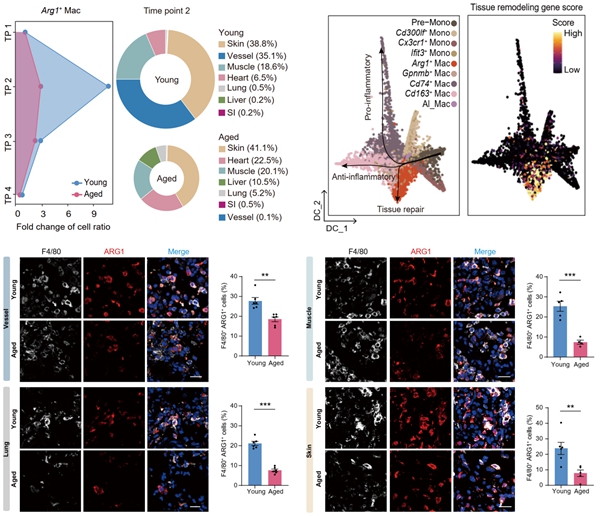
图1. 研究揭示与年轻组织高再生能力相关的巨噬细胞亚型
综上,该研究首次在系统水平解码了不同组织再生过程中的动态变化规律,阐明了增龄所致组织再生能力减损的细胞和分子机制,建立了再生和衰老的全新关联,揭示了调控哺乳动物再生的潜在细胞和分子靶标,为探讨多组织再生规律、剖析增龄导致的再生障碍,提供了宝贵的资源。此外,该研究鉴定出一类新型Arg1+巨噬细胞亚群,可能通过促进血管生成,参与促进组织损伤后的重塑和修复,提示靶向特定巨噬细胞有望干预衰老相关再生障碍,为发展延缓衰老的新策略提供了思路。该研究为实现组织器官修复、预防和治疗衰老相关疾病奠定了重要的理论基础(图2)。
图2. 系统解码衰老相关再生障碍的细胞分子机
该研究由动物所、北京基因组所、北京干细胞与再生医学研究院、首都医科大学宣武医院等合作完成。研究工作得到科学技术部、国家自然科学基金委员会、中国科学院和北京市等的支持。