
国重室分子影像与核医学研究中心李桢团队发现牛血清白蛋白(BSA)修饰的Cu2−xSe纳米颗粒联合近红外光照能显著促进神经干细胞定向分化为神经元,补充帕金森小鼠脑内丢失的神经元并恢复其功能,从而提高帕金森病的治疗效果。相关成果以“Modulating efficient differentiation of neural stem cells into neurons by using plasmonic nanoparticles and the NIR II irradiation to boost therapy of Parkinson’s disease”为题发表在Nano Today杂志上。
帕金森病是目前全球第二大神经退行性疾病,其常见的发病机制包括路易小体沉积、线粒体功能障碍、氧化应激和神经炎症等等。这些发病机制会相互促进和串扰,最终导致中脑黑质致密部区域多巴胺能神经元的进行性损伤和丢失,继而引起黑质-纹状体系统功能减退、多巴胺含量降低,从而促进帕金森病的发生与发展。因此,补充丢失的神经元是治疗帕金森病的重要策略之一。
神经干细胞是源于中枢神经系统的多能干细胞,具有自我更新和多向分化潜能,为治疗帕金森病提供了良好机遇。神经干细胞能够分化成神经元、星形胶质细胞和少突胶质细胞。然而,神经干细胞在无干扰下自然分化为神经元的效率较低,很难实现对神经损伤修复、促进神经再生以及治愈帕金森病等目的。因此,如何调控神经干细胞高效定向分化为神经元是神经干细胞治疗帕金森病的关键科学问题之一。
在前期工作中,分子影像与核医学研究中心李桢团队构建了基于Cu2-xSe的多功能纳米颗粒,用于调控小胶质细胞和神经元功能而提高帕金森病的治疗效果。首先,研究团队构建了靶向小胶质细胞、具有多重类酶活性的CSPQ仿生纳米颗粒,通过将小胶质细胞极化为具有神经保护作用的M2表型,缓解氧化应激引起的帕金森症状(J.Am.Chem.Soc.2020,142,21730−21742)。其次,研究团队在Cu2-xSe纳米颗粒表面耦联TRPV1抗体,利用Cu2-xSe优异的光热转化效应可控开启小胶质细胞表面的TRPV1离子通道,促进Ca2+内流而增强小胶质细胞的自噬水平和降解神经元外α-突触核蛋白聚集体的能力,进而改善帕金森病小鼠的运动和记忆能力(Adv. Mater.2022,34,2108435)。
由于α-突触核蛋白聚集体在神经元内形成,因此,阻止神经元内α-突触核蛋白发生病变聚集和及时清除α-突触核蛋白聚集体是从根本上解决α-突触核蛋白聚集体问题的重要策略。研究团队发现CSPQ纳米颗粒可以通过激活神经元Nrf2/Keap1/p62信号通路,促进神经元降解α-突触核蛋白聚集体并改善由其引起的帕金森症状(Nano Today 2023,49,101770)。此外,研究团队还构建了靶向神经元线粒体的超小纳米颗粒,通过激活受损神经元的SIRT1/PGC-1α信号通路,介导线粒体生物发生,缓解神经元线粒体功能障碍从而改善帕金森病症状(Adv.Sci.2023,e2300758)。
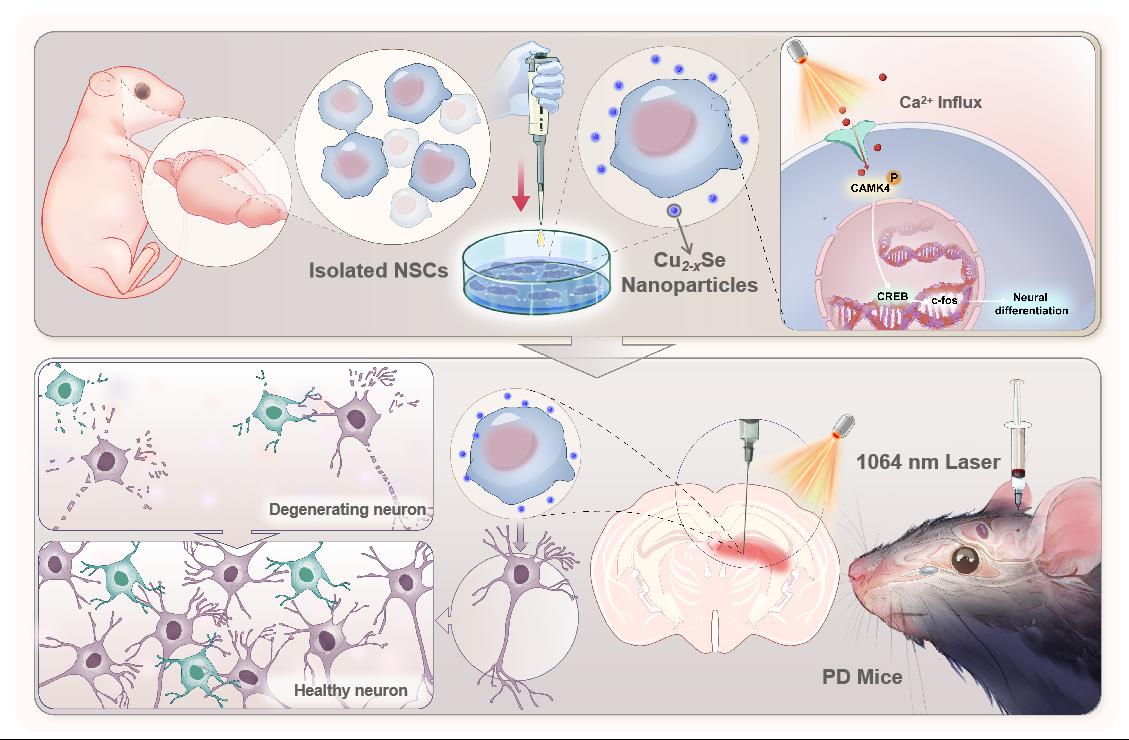
图1. Cu2-xSe纳米颗粒联合1064 nm激光调控神经干细胞定向分化为神经元,治疗帕金森病小鼠的示意图。
基于上述基础,研究团队发现Cu2-xSe纳米颗粒联合1064 nm近红外激光作用能够开启神经干细胞膜表面的电压门控钙离子通道(VGCC),促进Ca2+内流,激活神经干细胞,并通过Ca2+/CaMK/CREB/c-Fos通路促进神经发生进程,最终达到调控神经干细胞加速定向分化为成熟的功能性神经元的目的(图1)。本研究为治疗帕金森病或其它神经元功能损伤相关疾病提供了新思路。