
CAR/TCR T细胞疗法,即具有工程化嵌合抗原受体(CAR)或T细胞受体(TCR)的T细胞,已在多种癌症治疗中展现出希望,特别是对于那些对常规疗法不再有效的患者。然而,正如最近在伦敦举行的CAR-TCR欧洲峰会上几位科学家所指出的,CAR/TCR T细胞疗法面临的挑战导致高成本和有限的可及性。
“对高级疗法的投资正在减少,因此药物开发商正在限制他们的研发管线以节省成本,”WuXi Advanced Therapies的质粒工程和慢病毒载体负责人Qian Liu博士指出。“这意味着许多疗法的监管审批和商业化进程变得缓慢,价格通常也很昂贵,限制了市场和患者的可及性。”
Catalent Biologics的全球产品开发副总裁Victor Vinci博士补充道:“细胞治疗的许多成本和时间问题与生产的复杂性有关。患者T细胞的初始质量、试剂、培养基和不同生产阶段所用的设备和自动化水平都存在变异,这意味着目前没有一种通用的CAR T细胞生产解决方案。”
优化生产过程
提高生产效率对于扩大生产规模、降低成本并最终使CAR/TCR T细胞疗法更易于患者获得至关重要。然而,CAR/TCR T细胞疗法的生产过程非常复杂,涉及多步骤,包括单采、T细胞选择、基因修饰、转导、扩增、纯化和填充/完成。
Immatics的CMC高级副总裁Ali Mohamed博士讨论了如何评估生产过程中的不同步骤,以提高公司ACTengine IMA203和IMA203CD8 TCR工程化T细胞(TCR-T细胞)靶向PRAME(黑色素瘤中优先表达的抗原)的生产。“ACTengine是我们针对晚期实体瘤患者的个性化细胞治疗方法,”他说。
Mohamed博士表示,Immatics的科学家对标准的TCR-T细胞生产方法进行了多项改进。例如,他们在转导阶段改为无血清培养,这显著增加了转染的T细胞数量,同时不影响细胞活力、细胞扩增或细胞表型。
另一个改进是通过将T细胞放置在塑料器皿(如CellSTACK)中休息数小时,以去除单核细胞和贴壁细胞。“单核细胞在单采过程中可能占我们收集的T细胞的50%,”Mohamed解释道。“它们有时会识别病毒载体为外来物并将其破坏,导致其快速清除和较低的T细胞转导率。通过去除这些单核细胞,我们的转导率显著提高。”
目前的生产过程使用特定抗体富集CD4和CD8 T细胞,从而替代已被耗尽的贴壁细胞。“通过选择CD8和CD4细胞,我们可以在生产过程开始时使用定义的T细胞群体,”Mohamed解释道。“这可以增加生产足够数量的TCR-T细胞以达到所需细胞剂量的机会。”
“通过这三项工艺优化步骤,我们可以在14天内生产出II期推荐剂量(RP2D,1–10 × 10^9个TCR-T细胞)的TCR-T细胞,其中包括7天的生产时间和7天的质量控制放行测试。使用我们的优化工艺,我们增加了播种密度,使用更少的容器。这些特性帮助我们降低成本,缩短周转时间,并更快地向患者提供细胞产品,同时保持超过95%的生产成功率。”
Catalent的Vinci也强调了工艺优化对于降低风险和简化生产路径的重要性。他补充道:“我们采用质量设计的方法进行工艺优化,并开发了我们的UpTempo CAR T细胞治疗平台用于生产自体细胞治疗。”
据Vinci介绍,Catalent的平台提供了一个模块化、灵活的CAR T细胞cGMP工作流程,使用无菌连接的封闭系统,包括G-Rex、Xuri和CliniMACS Prodigy,来自动化、评估和优化生产过程。“我们生产的T细胞疗法在收获时通常具有约90%的细胞活力,”Vinci指出。“这确保了我们的生产效率,从而降低了成本。”
改善病毒基因传递
为了减少CAR T细胞疗法生产中的一些成本,WuXi Advanced Therapies正在开发XOFLX包装和生产细胞系等技术。这些细胞系旨在降低生产慢病毒载体(LVV)的成本,LVV通常用于细胞治疗中的治疗基因传递,因为它们可以有效地永久修饰T细胞,并具有可靠的安全性。
“LVV生产的行业标准是使用四种质粒——包含目标基因的转移载体、两个包装质粒和一个包膜质粒,”Liu指出。“我们通过XOFLX系统首先开发了一种包装细胞系,该细胞系将所有LVV包装元素稳定整合到细胞基因组中,仅需一个转移质粒即可进行LVV生产。此外,我们还开发了XOFLX生产细胞系,这些细胞系还整合了包含治疗基因的LVV基因组,允许无转染的LVV生产。”
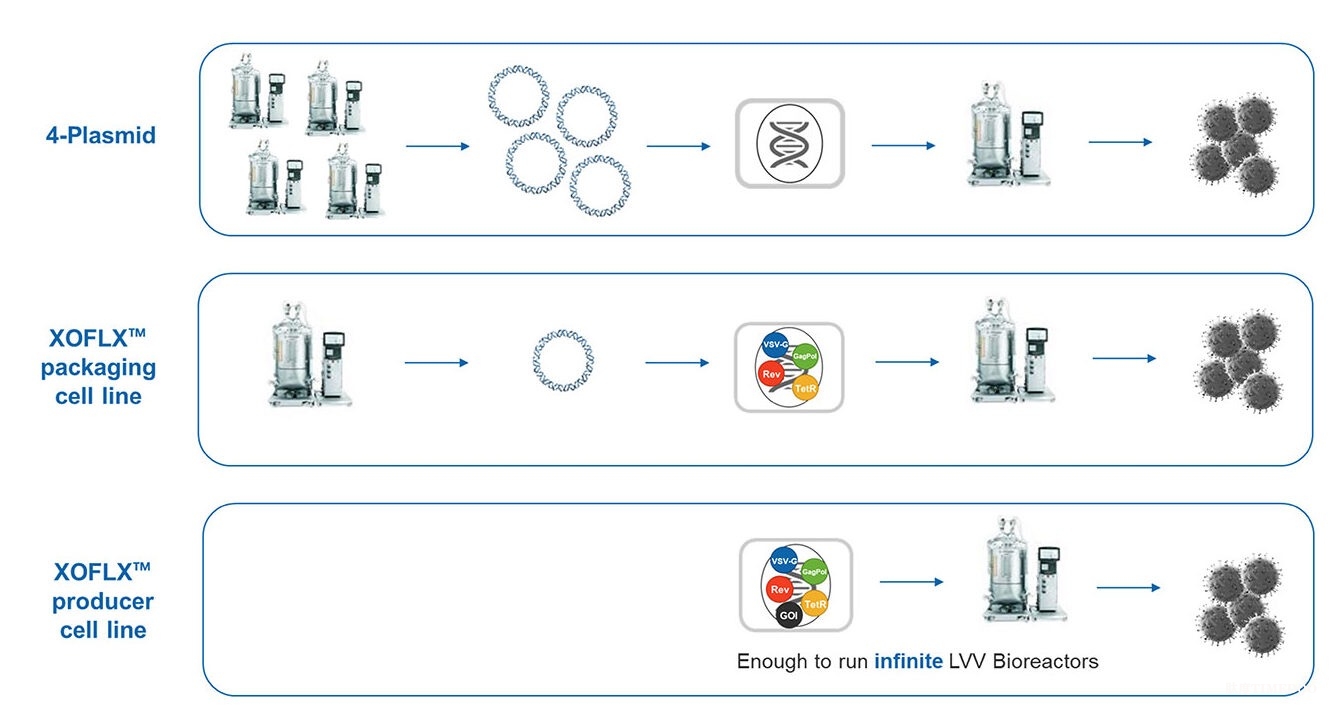
药明生物的 XOFLX 包装和生产细胞系旨在提供简化且高产的慢病毒载体 (LVV) 制造系统。该系统经过精心设计,可降低表达盒之间的同源性,从而提高安全性。
Liu展示的数据表明,在10升规模下,XOFLX包装细胞系与WuXi Advanced Therapies的传统LVV生产系统相比,产生了可比的LVV滴度。研究细胞库和主细胞库已经为包装细胞系创建。她还展示了1升规模下编码增强绿色荧光蛋白或治疗转基因的XOFLX生产细胞系的LVV生产数据。数据表明,由于简化的无转染过程,生产可以轻松从摇瓶扩展。
Liu总结道:“由于我们的XOFLX系统在LVV生产中仅使用一个转移质粒或完全不使用质粒,这减少了质粒的使用成本和LVV生产的复杂性,为药物开发商和最终的患者提供了成本和质量的优势。”
选择非病毒传递路径
GenomeFrontier Therapeutics的业务发展总监Ting-Wan Lin博士表示,该公司专注于制造先进且负担得起的细胞疗法,但选择了使用非病毒细胞工程的少见路径。“尽管病毒载体设计取得了进展,但基于病毒的基因疗法载体存在一些挑战和/或缺点,如固有的安全性问题、昂贵的载体生产和有限的负载能力,”她指出。“非病毒细胞工程方法可以克服这些缺点。”
然而,Lin补充说,非病毒方法也存在其他挑战。这些挑战包括基因传递率低、基因整合效率差和由于电穿孔基因传递导致的细胞扩增能力低。
为了克服当前使用病毒或非病毒细胞工程技术所遇到的挑战,GenomeFrontier Therapeutics开发了Quantum Engine,这是一项促进高质量、临床规模和无病毒细胞及基因治疗产品开发和生产的技术。该系统集成了四个平台:G-Tailor、Quantum pBac、Quantum Nufect和iCellar,分别用于候选基因设计、治疗基因整合、基因传递和细胞扩增。

GenomeFrontier Therapeutics 整合了四个平台:G-Tailor、Quantum pBac、Quantum Nufect 和 iCellar,分别用于改进基因设计、治疗基因整合、基因传递和细胞扩增能力。这些平台共同构成了 Quantum Engine,旨在生产无病毒细胞和基因治疗产品。
“Quantum pBac是Quantum Engine的关键平台,是我们专有的piggyBac转座子,与商用的超活性piggyBac相比,它在整合更大基因时潜在更安全且更有效,”Lin表示。“通过精细调控Quantum pBac与其他三个平台,我们最近开发了一个强大的Quantum Engine,名为Quantum CART(qCART),用于多重CAR T细胞的开发和生产。”
Lin展示的数据表明,qCART生产的CAR T细胞产生了更高比例的CAR+干细胞样记忆T细胞,具有CD4和CD8,并且表达衰老/疲劳标记物低且扩增能力强。此外,这些CAR T细胞在淋巴瘤和胃癌实体瘤小鼠模型中表现出强大的抗肿瘤效力。
“我们的qCART系统不仅使我们能够以高质量和临床规模生产CAR T细胞,具有良好的产品一致性,且时间和成本效益高,还能够在衰竭患者中恢复老化和疲劳的T细胞,”Lin指出。“Quantum Engine是一项强大的技术,使我们能够利用piggyBac建立细胞和基因治疗管线,从而站在巨人的肩膀上。我们的领先候选产品GF-CART01是一种靶向CD20/CD19的CAR T细胞疗法,用于治疗B细胞恶性肿瘤,在小鼠的临床前研究中表现出令人鼓舞的结果,我们正在寻找合作伙伴。”
提高生产效率对于扩大生产规模、降低成本并提高CAR/TCR T细胞疗法的可及性至关重要。CAR-TCR欧洲峰会的发言者一致认为,通过采用封闭自动化系统和标准化与优化策略,制造商可以克服现有挑战,实现CAR T细胞疗法的变革潜力。