
在一项新的研究中,来自阿尔伯特-爱因斯坦医学院的研究人员取得了重大进展,他们发现了一种改良的CAR-T细胞疗法,该疗法针对实体瘤展现出了前所未有的疗效,这一成果或将重塑癌症治疗格局。相关研究结果近期发表在Science Advances期刊上,论文标题为“TOP CAR with TMIGD2 as a safe and effective costimulatory domain in CAR cells treating human solid tumors”。
研究通讯作者Xingxing Zang博士表示:“CAR-T细胞疗法在血癌治疗领域已取得革命性成就,但在实体瘤面前却屡屡受挫。我们惊喜地发现,通过优化标准CAR-T细胞疗法,其对实体瘤,尤其是胰腺癌和胶质母细胞瘤这类难治性癌症的治疗效果得到了显著提升。”
开发个性化癌症杀手
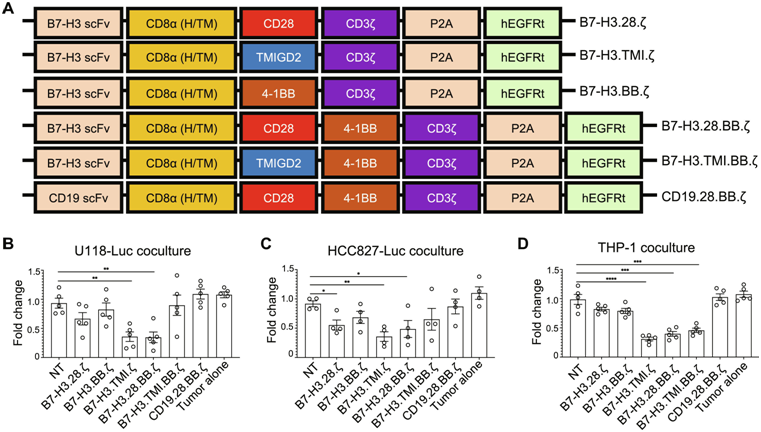
Zang博士和他的同事们开发出五种CAR-T细胞疗法,并在移植了人类实体瘤的小鼠模型上进行了实验。其中,一种疗法因融合了两项新颖元素而脱颖而出,它不仅安全有效地缩减了胶质母细胞瘤和胰腺肿瘤,同时也对肺癌肿瘤产生了显著的抑制效果。
CAR-T细胞疗法,全称嵌合抗原受体T细胞疗法,被誉为基因工程的杰作,能够将免疫系统中的T细胞转化为精准打击癌细胞的“活体导弹”。该疗法涉及从患者体内提取T细胞,并通过基因工程技术植入编码CAR的基因。经过改造的CAR-T细胞可在体外大量扩增,随后回输至患者体内,其表面表达的合成CAR受体能够识别并锁定癌细胞上的特定抗原,触发T细胞的攻击机制。
五种CAR-T细胞对抗三种癌症
Zang博士团队的五种CAR-T细胞疗法均采用了同一种新型的靶向蛋白——一种能与B7-H3结合的单克隆抗体,B7-H3是一种广泛存在于多数实体瘤及其血管表面的抗原。在此前的研究中,Zang博士已揭示B7-H3如何干扰T细胞功能,协助肿瘤逃脱免疫系统的追捕。为了克服这一障碍,Zang博士指出:“我们希望设计的CAR不仅能引导T细胞定位实体瘤,还能通过特异性结合B7-H3,阻止其削弱T细胞攻击和清除癌细胞及其血管的能力。”
然而,仅靠结合肿瘤细胞尚不足以确保癌细胞的死亡。为了激活T细胞,CAR还需包含一种共刺激蛋白。在Zang博士实验室研发的五种CAR-T细胞疗法中,四种采用了传统共刺激蛋白,而第五种则引入了一种前所未有的蛋白——TMIGD2。
2015年,Zang博士发现T细胞拥有一种称之TMIGD2的受体,这种受体在受到刺激时能激活T细胞(Clinical Cancer Research, 2025, doi:10.1158/1078-0432.CCR-14-1495)。他后来意识到,将TMIGD2整入到CAR-T细胞可能使它们克服实体瘤带来的挑战。
图片来自Science Advances, 2024, doi:10.1126/sciadv.adk1857
“实体瘤内部低氧条件与免疫检查点的存在,形成了一个对T细胞极其不利的微环境,限制了它们的渗透能力和免疫攻击力。TMIGD2作为共刺激蛋白,似乎能够为CAR-T细胞注入足够的动力,使其穿透实体瘤的密集结缔组织,抵达癌细胞并长期驻留。”Zang博士解释道。
TOP CAR
实验结果显示,携带胰腺癌、肺癌和胶质母细胞瘤的小鼠在接受了新型CAR-T细胞疗法后,展现出令人鼓舞的疗效。其中,最引人注目的疗法结合了新型抗体与TMIGD2蛋白,被命名为TMIGD2优化效力/持久性(Optimized Potent/Persistent, TOP)CAR。
使用TOP CAR的CAR-T细胞疗法在胰腺、肺和胶质母细胞瘤小鼠模型中表现卓越,显著提高了小鼠的存活率。例如,在胶质母细胞瘤小鼠中,TOP CAR T细胞疗法使7只中的6只存活下来,而其他CAR-T疗法仅能挽救3只中的1只。此外,TOP CAR T细胞疗法在有效性和安全性指标上均展现出优势。
展望未来,Zang博士计划进一步完善TOP CAR技术,构建一个“现成”平台,该平台不仅能靶向B7-H3,还可同时识别多种肿瘤抗原,适用于各类实体瘤的治疗。
阿尔伯特-爱因斯坦医学院已对Zang博士的科研成果采取了知识产权保护措施,并正积极寻求商业合作伙伴,旨在将这种革新性的TOP CAR T细胞疗法尽快推进至临床试验阶段,为脑癌、肝癌、胰腺癌、卵巢癌、前列腺癌、肺癌、膀胱癌和结肠癌等多种癌症患者带来福音。